Entomologia forense: i Ditteri terrestri, da pupari ad adulti
«È difficile trovare un altro gruppo di animali in cui si presenti la varietà di rapporti con l’ambiente esterno che si riscontra nei Ditteri, tanto più che tali rapporti cambiano con lo stadio della vita» (Bacetti e Cobolli)
Larve post-feeding, pupari e adulti di Ditteri Ciclorrafi
«Un’alimentazione fenomenale provoca una crescita fenomenale» (Greenberg e Kunich, 2002)
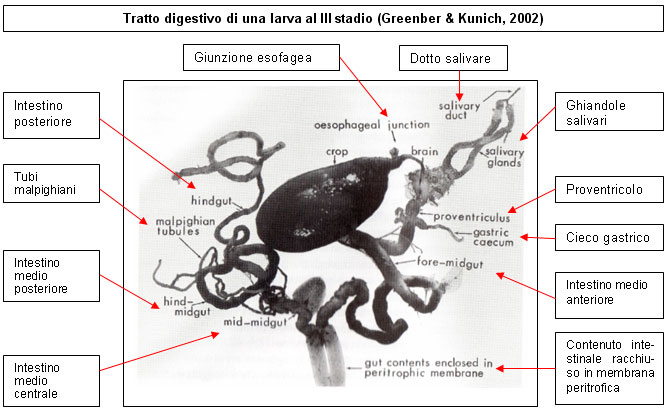
Una larva di Calliphora appena uscita dall’uovo pesa 1 milligrammo, mentre dopo cinque giorni la sua massa è aumentata di più di 800 volte (0.82÷0.84 grammi). Nel corso di tale rapidissima crescita si verificano due mute e solo grazie alla sua elasticità la cuticola può resistere ad un aumento di lunghezza di circa 10 volte, oltre che ad un analogo incremento della sezione. Una larva di Calliphora vicina lunga un centimetro ha un tratto intestinale lungo più di 7 centimetri, più del doppio di quello che si riscontra nell’adulto. L’alimentazione è continua e dal momento che la larva ingerisce più cibo di quanto ne digerisce, l’eccesso viene accumulato nel gozzo (crop), visibile in trasparenza a livello addominale. Il gozzo è parte del pre-intestino, ed ha una copertura di cuticola che protegge la sua forma anche dopo la morte della larva. Quando l’intestino si svuota, il cibo assimilato si converte in uno strato di cellule ricche di grassi, sorgente primaria di energia durante la metamorfosi. Al massimo del regime di alimentazione il gozzo assomiglia ad un palloncino, visibile nella parte anteriore della larva.
Per alcune specie la lunghezza del gozzo può essere un indicatore estremamente affidabile dell’età delle larve (Greenberg e Kunich, 2002). Una larva raggiunge la sua massima lunghezza l’ultimo giorno in cui si alimenta. Quando la larva smette di nutrirsi e diventa vagante, il gozzo funziona vagamente come il rumine di una mucca, scaricando gradualmente il suo contenuto nel tratto digestivo, nel quale viene successivamente elaborato. Nel primo giorno post–feeding (cioè successivo all’interruzione dell’alimentazione) il gozzo si svuota rapidamente e in questa fase stime significative dell’età della larva possono essere eseguite misurando la lunghezza del gozzo. Durante i due giorni successivi il gozzo si svuota molto lentamente e di conseguenza la stima diventa più difficile poiché i dati rilevati tendono a sovrapporsi. Un giorno prima dell’impupamento il gozzo subisce la riduzione finale.
Larve secche, raccolte da resti o da tessuti alcuni anni dopo la loro morte, possono ancora conservare un gozzo misurabile in grado di rivelare l’età delle larve nel momento in cui furono uccise (Greenberg e Kunich, 2002).
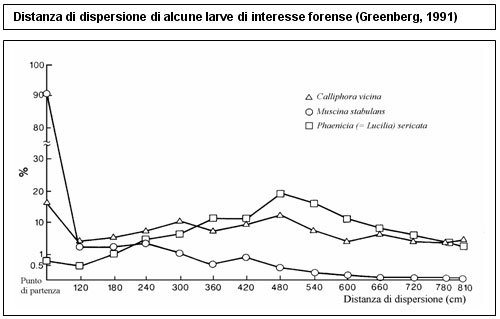
Via via che passano le ore e i giorni è l’esoscheletro delle larve del terzo stadio a formare la resistente custodia esterna dei pupari e a cambiare colore, virando prima al bianco-crema per poi passare ad un marroncino chiaro fino ad un rosso mattone. La larva post–feeding è una larva ancora del terzo stadio, ma al suo interno avvengono cambiamenti nel tratto digestivo importanti dal punto di vista forense. Generalmente le larve si allontanano dal substrato su cui si sono nutrite fino a quel momento per cercare un luogo riparato in cui risultare protette dai predatori o da condizioni climatiche avverse, spesso cambiando tipologia di ambiente (da umido a secco o dalla superficie all’interno del terreno). Quando la larva cessa di vagare, diventa immobile e ritira le sue estremità anteriore e posteriore in un pupario fatto come una palla da football, in preparazione alla metamorfosi (Greenberg e Kunich, 2002). Già alcuni anni prima di questi risultati (1990, 1998) Greenberg aveva diretto i suoi studi sui pupari: partendo dal presupposto che una mosca trascorre circa il 40% della sua vita in questo stadio, è certamente importante esaminare le migrazioni delle larve post-feeding prima dell’impupamento e comprendere i cambiamenti che avvengono sulla superficie e all’interno dei pupari.
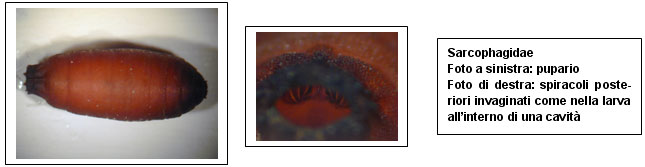
I pupari assumono una forma cilindrica con le estremità arrotondate, risultando perciò simili a barilotti, e il colore passa gradualmente dal bianco giallastro al rosso mattone. Le caratteristiche più evidenti sono le spine, gli spiracoli della larva (in questa fase non più funzionanti) ed eventuali corni respiratori. Le spine, come il resto del corpo, diventano scure, ma i dettagli strutturali specifici rimangono riconoscibili. Gli spiracoli anteriori della larva sono presenti all’estremità anteriore del pupario come strutture a forma di ventaglio, di colore più chiaro (bruno-arancio), mentre quelli posteriori diventano pesantemente sclerotizzati e la loro struttura non permette una facile identificazione. Gli apparati funzionali esterni in questo stadio sono i corni respiratori, collocati dorso-lateralmente sul margine posteriore del quinto segmento: sono strutture cave, ad uncino, che puntano in avanti e verso l’esterno e, come per gli spiracoli anteriori, sono di colore più chiaro rispetto al resto del pupario.
Le seguenti immagini al microscopio a scansione a pressione variabile (SEM) sono state realizzate dalla dottoressa Mattutino presso il Dipartimento di medicina legale dell’Università di Torino.
Dopo un periodo che varia da specie a specie si assiste allo sfarfallamento dell’insetto adulto. L’apertura del pupario avviene su linee di minore resistenza per la pressione che l’insetto esercita ritmicamente con la propria estremità cefalica contro l’involucro che la racchiude: si fa quindi strada attraverso l’apertura fatta nella cuticola, in un tempo variabile da pochi minuti ad un’ora. In questo periodo la mosca pompa l’emolinfa nelle ali e nelle altre strutture distali. Per alcune ore l’esoscheletro rimane semitrasparente: per tale ragione in questa fase l’insetto viene detto mosca “bianca”. Dopo un periodo di 3÷5 giorni (in dipendenza anche della temperatura ambientale), dopo aver assunto cibo contenente proteine e carboidrati, gli adulti diventano maturi e pronti per l’accoppiamento, dando il via ad un nuovo ciclo vitale.
Le differenze morfologiche negli adulti sono innumerevoli, soprattutto quando si intraprende la strada della determinazione della specie. Sono di seguito mostrate alcune foto esemplificative di individui appartenenti a diverse famiglie, senza tuttavia addentrarci nella loro descrizione.
Larve post-feeding, pupari e adulti di Ditteri Ortorrafi
Nelle larve della famiglia Stratiomyidae l’impupamento avviene nell’ultimo tegumento (ossia nell’ultimo rivestimento cutaneo) larvale. Ciò comporta che, ad esempio nel caso della specie Hermetia illucens, l’ultimo e il penultimo stadio larvale presentano differenze così marcate da farle sembrare larve di specie diverse. Nel penultimo stadio, quello più giovane, la larva possiede ancora un apparato boccale mobile funzionante, poiché è ancora una larva che si nutre, mentre nello stadio finale possiamo distinguere due diverse fasi:
1) larva ancora attiva e in grado di spostarsi velocemente, denominata da Schremmer (1986) wander larve, ossia larva viaggiante; in questo stadio si possono osservare e riconoscere le prime modificazioni dell’apparato boccale, oltre alla fessura dorsale toracica da cui in seguito uscirà l’adulto;
2) cessa l’impulso migratorio, la larva si ferma in un luogo adatto più secco e si irrigidisce, per diventare pupa.
I cambiamenti morfologici dagli stadi di larva migrante a quello di larva immobile e di pupa sono riassumibili in:
- riduzione delle parti boccali e successivo irrigidimento, a causa anche di deposizioni esterne di carbonato di calcio;
- trasformazione della punta della testa, che nella larva era affusolata e curvata verso l’alto, mentre nella pupario è arrotondata e arcuata verso il basso, rassomigliando al becco di un uccello rapace;
- curvatura laterale in avanti degli occhi, posti più anteriormente, probabilmente con la funzione di orientamento verso la luce, soprattutto per la ricerca del luogo di impupamento. La parte anteriore dorsale (dove si trovano le linee di rottura per lo sfarfallamento) si posiziona verso l’alto, in direzione della luce, in modo da facilitare la fuoriuscita dell’adulto;
- formazione di incrostazioni calcaree: la pelle del pupario, rispetto a quella di una larva giovane, è più robusta e resistente grazie alla presenza di incrostazioni di carbonato di calcio, molto più evidenti a livello dell’apparato boccale.
Per stabilire se la larva è matura e pronta per diventare pupa, è necessario ricercare la presenza delle linee di frattura: si tratta di tre linee, due trasversali (di cui quella anteriore è completa e si trova tra i segmenti TI e TII) e una dorso-mediana, la quale si unisce verticalmente alle trasversali. Insieme formano una sorta di I, che durante lo sfarfallamento viene lacerata, con perdita del primo segmento e della capsula cefalica. Attraverso la spaccatura viene fuori prima la testa e poi la groppa posteriore del busto della mosca adulta.
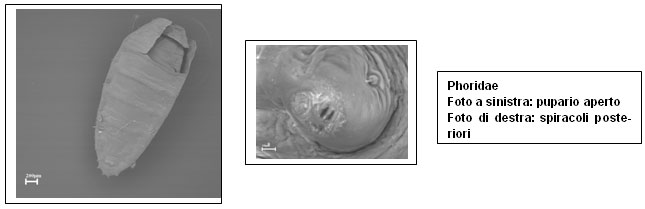
Le seguenti immagini al microscopio a scansione a pressione variabile (SEM) sono state realizzate dalla dottoressa Mattutino presso il Dipartimento di medicina legale dell’Università di Torino.

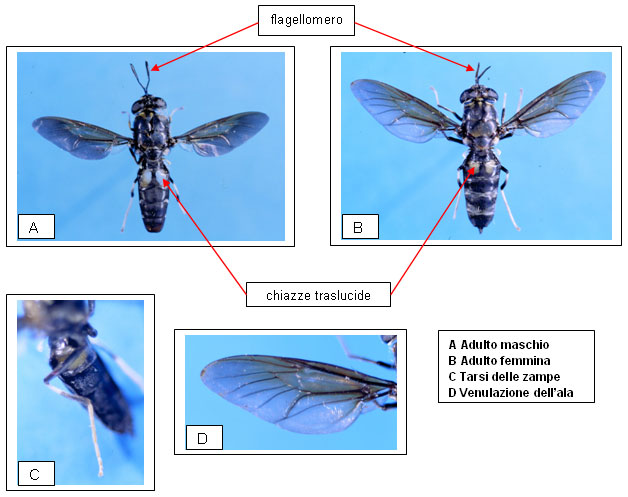
Gli adulti sono insetti di media grandezza, piuttosto appiattiti ventralmente, con la lunghezza del corpo di 12÷20 mm, spesso con le femmine di dimensioni maggiori.
La testa è emisferica, ampia come il torace, dotata di occhi composti e assai sviluppati, maggiormente separati nella femmina. Le antenne sono lunghe almeno il doppio della testa, con il flagello composto da 5÷8 flagellomeri, l’ultimo dei quali terminante a paletta.
La proboscide è carnosa, mai adatta a pungere bensì a succhiare liquidi.
Le ali, di lunghezza da 8 a 15 mm, sono fortemente scurite di bruno e presentano la caratteristica piccola cella discoidale.
L’addome è composto da 5 a 8 segmenti visibili e caratteristica è la coppia di chiazze traslucide presenti sul secondo segmento. Nei maschi il colore di fondo è il nero e la coppia di macchie è traslucida e bianca; nelle femmine di solito le macchie sono molto più piccole e spesso giallastre o rossastre per la folta peluria.
Le zampe sono di colore nero, con tarsi bianchi.
Bibliografia
Bacetti B., Cobolli M. (1991), Phylum Arthropoda. Sezione Insecta, in «Trattato Italiano, AA.VV., Volume II», eds Zanichelli, 812-814.
Byrd J.H., Castner J.L., (2010), Forensic Entomology: The utility of Arthropods in Legal Investigations. CPR Press, Taylor & Francis Group, LLC.
Catts E.P., Goff M.L. (1992), Forensic entomology in criminal investigations. «Ann. Rev. Entomol.», 37: 252-72.
Catts E.P., Haskell N.H. (1990) Entomology & Death: a procedural guide, editore Joyce’s Print Shop, Inc., Clemson, South Carolina.
Copello A. (1926) Biologia de Hermetia illuscens, «Revista de la S.E.A.», 2: 23-7
Disney R.H.L. (1983) Scuttle flies (Diptera, Phoridae), «Handbook for the identification of British Insects», pp 1-81.
Erzinçlioglu Y.Z. (1985), Immature stages of British Calliphora e Cynomya with a re-evaluation of the taxonomic characters of larval Calliphoridae (Diptera), in «Journal of Natural History ».
Greenberg B. (1990), Behavior of post feeding larvae of some Calliphoridae and a Muscid (Diptera), in «Ann. Entomol. Soc. Am. », 83 (6): 1210-4.
Greenberg B. (1991), Flies as forensic indicators, in «Journal of Medical Entomology», 28 (5): 565-77.
Greenberg B., Kunich J.C. (2002), Entomology and the law: flies as forensic indicators, editore Cambrige
Greenberg B. (1998), Reproductive status of some overwintering domestic flies (Diptera: Muscidae and Calliphoridae) with forensic implications, in «Ann. Entomol. Soc. Am. », 91 (6): 812-20.
Haskell N.H., Hall R.D., Cervenka V.J., Clark M.A. (1997), On the body: Insects’ life stage presence and their postmortem artifacts, in Haglund W.D., Sorg M.A., Forensic taphonomy: the postmortem fate of human remains. CRC Press, Boston 415-448.
Hobson R.P. (1932), Studies on the nutrition of blow fly larvae, in «Journal of Experimental Biology», 9: 359-65.
Lundt H. (1964), Okologische untersuchugen uber die tierisch besiedlung von aas im boden, «Pedobiologia», 4: 158-80.
May B.M. (1961), The occourrence in New Zealand and the life-history ogìf the soldier fly Hermetia illucens (L.), (Diptera Stratiomyidae), «New Zealand Journal of Science», 4: 55-65.
Mégnin J.P. (1894), La faune de cadavres. Application de l’entomologie à la médicine légale, Enciclopedie Scientifique des Aides Memories, editore Masson, Paris.
Payne J.A. (1965), A summer carrion study of the baby pig Sus scrofa Linnaeus, in «Ecology», 46 (5): 592-602.
Rozkosny R. (1982-1983), A biosistematic stady of European Stratiomyidae (Diptera) Vol. 1 e 2, eds Junk, The Hague, Nederlands, 415.
Schremmer V.F. (1986), The polymetabol development of the soldier fly larva Hermetia illucens. A contribution to the metamorphosis of the Stratiomyidae, in «Ann. Naturhist. Mus. Wien», 88-89: 405-29.
Smith K.V.G. (1986), A manual of forensic entomology, British Museum (Natural History), London.
Smith K.V.G. (1989), An introduction to the immature stages of British flies, British Museum (Natural History), London.
Turner B.D. (1987), Forensic entomology: insects against crime in «Sci. Prog. Oxf.», 71: 133-44.
Turner B.D. (1991), Forensic entomology in «Forensic Sci. Prog.», 5: 129-51.
Von Zuben C.J., Bassenezi R.C., dos Reis S.F., Godoy W.A.C., Von Zuben F.J. (1996), Theoretical approaches to forensic entomology: I mathematical model of postfeeding larval dispersal, in «J. Appl. Ent. », 120: 379-82.